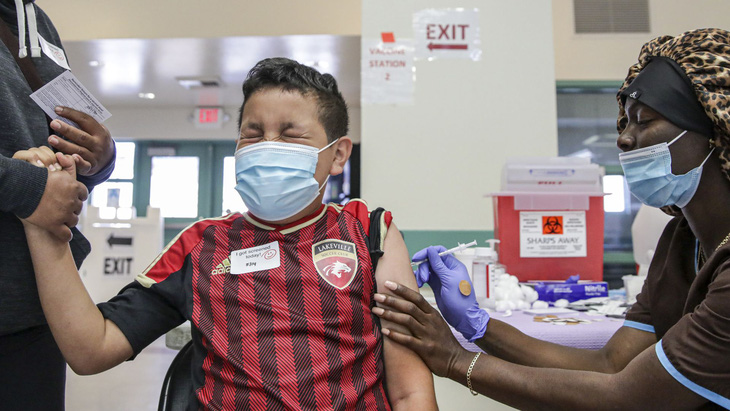
Cậu bé Ivan Hernandez (13 tuổi) tiêm vắc xin COVID-19 của Hãng Pfizer tại điểm tiêm chủng ở thành phố Los Angeles, Mỹ - Ảnh: GETTY IMAGES
Theo Đài CNN, đây là lần đầu tiên FDA nhận được dữ liệu về vắc xin COVID-19 cho trẻ em dưới 12 tuổi.
Trước đó, vắc xin Pfizer/BioNTech đã được cấp phép sử dụng đầy đủ cho người từ 16 tuổi trở lên, và được cấp phép sử dụng khẩn cấp (EUA) cho trẻ từ 12-15 tuổi.
Giám đốc điều hành Pfizer - ông Albert Bourla - nói ông không biết quá trình xem xét dữ liệu của FDA kéo dài bao lâu, điều đó hoàn toàn tùy thuộc vào cơ quan này.
Tuần trước, trong thông cáo ngày 20-9, Pfizer và đối tác BioNTech cho biết vắc xin hai liều của họ an toàn và sinh phản ứng miễn dịch tốt với trẻ từ 5-11 tuổi.
Dữ liệu của Pfizer thu được từ thử nghiệm với 2.268 trẻ trong nhóm tuổi này, với liệu trình tiêm hai liều cách nhau 21 ngày.
Trong thử nghiệm này, trẻ từ 5-11 tuổi được tiêm liều vắc xin 10 mcg, ít hơn so với liều 30 mcg được dùng để tiêm cho người từ 12 tuổi trở lên.
Phản ứng miễn dịch của nhóm trẻ tham gia thử nghiệm được đo bằng mức kháng thể trung hòa trong máu, và so với mức kháng thể trung hòa của nhóm người từ 16-25 tuổi đã tiêm hai liều, với mức 30 mcg/liều.
Pfizer và BioNTech khẳng định vắc xin của họ "an toàn, dung nạp tốt, cho phản ứng kháng thể trung hòa mạnh mẽ" với nhóm trẻ từ 5-11 tuổi.
Ngày 28-9, Pfizer và BioNTech cho biết họ có kế hoạch nộp dữ liệu cho Cơ quan Dược phẩm châu Âu và các cơ quan quản lý khác. Đồng thời cũng sẽ nộp dữ liệu đầy đủ về kết quả thử nghiệm lâm sàng giai đoạn ba để giới khoa học bình duyệt.
Giới chức FDA cho biết sau khi nhận đủ dữ liệu thử nghiệm, cơ quan này có thể cấp phép vắc xin cho trẻ nhỏ hơn trong vòng vài tuần chứ không phải vài tháng. Song, điều này phụ thuộc vào thời gian và chất lượng của dữ liệu đã nộp.
Trước đây FDA đã nhanh chóng cấp phép sử dụng vắc xin cho các nhóm tuổi khác. Ví dụ, ngày 9-4, Pfizer nộp đơn xin cấp phép vắc xin cho trẻ từ 12-15 tuổi, thì tới ngày 10-5, FDA đã cấp phép khẩn cấp cho vắc xin này.
Tuy nhiên, theo CNN, với nhóm trẻ nhỏ hơn, FDA sẽ phải triệu tập ban cố vấn vắc xin để nghe khuyến nghị trước khi cấp phép.
Sau thông báo ngày 28-9 của Pfizer, tiến sĩ Anthony Fauci - chuyên gia bệnh truyền nhiễm hàng đầu Mỹ - cho biết ông hy vọng vắc xin có thể được tiêm cho trẻ trong nhóm tuổi từ 5-11 vào cuối tháng 10 tới.
Cũng trong ngày 28-9, Pfizer cho biết dự kiến dữ liệu về phản ứng miễn dịch và an toàn của vắc xin COVID-19 đối với 2 nhóm tuổi từ 2-5 và từ 6 tháng đến 2 tuổi có thể có sớm nhất vào quý 4 năm nay.












Tối đa: 1500 ký tự
Hiện chưa có bình luận nào, hãy là người đầu tiên bình luận